Os microRNAs (miRNA/miR) são RNAs não codificantes curtos, de 20 a 22 nucleotídeos, que desempenham um papel crucial na regulação gênica ao interagir com moléculas de RNA mensageiro (mRNA) alvo. Estima-se que os microRNAs possam modular até 60% dos genes codificadores de proteínas no genoma humano no nível da tradução. Eles participam de vários processos fisiológicos, como diferenciação, proliferação, apoptose e desenvolvimento, e sua desregulação tem sido relacionada a vários distúrbios patológicos.
A importância do microRNA foi destacada pelo Prêmio Nobel de Fisiologia ou Medicina de 2024, concedido a Victor Ambros e Gary Ruvkun “pela descoberta do microRNA e seu papel na regulação pós-transcricional dos genes”. Esses cientistas publicaram pela primeira vez sua descoberta do microRNA em 1993 e, em 2000, o grupo de pesquisa de Ruvkun identificou o let-7, um microRNA codificado pelo gene let-7, que é altamente conservado em várias espécies animais. Desde então, houve um interesse significativo no desenvolvimento de terapêuticas de microRNA.
Os problemas relacionados à toxicidade e à administração eficaz desses ácidos nucleicos continuam a ser um desafio. Menos de 20 terapêuticas de microRNA entraram em ensaios clínicos, nenhuma das quais está na fase III. Aproximadamente metade dos ensaios terapêuticos de microRNA iniciados teve que ser suspensa ou encerrada devido à toxicidade do microRNA e a outros efeitos colaterais graves.
No entanto, novas pesquisas estão avançando. Os avanços nos sistemas de administração de medicamentos em nanoescala estão abordando questões de eficácia e toxicidade, e as terapêuticas de microRNA podem ser mais amplamente utilizadas à medida que os métodos de administração continuam a melhorar.
Biogênese de microRNA e mecanismo de ação
O microRNA pode ser encontrado como unidades transcricionais independentes ou incorporado a íntrons ou exons de outros genes. Há duas vias de biogênese de microRNA: a via canônica e a via não canônica (veja a Figura 1).
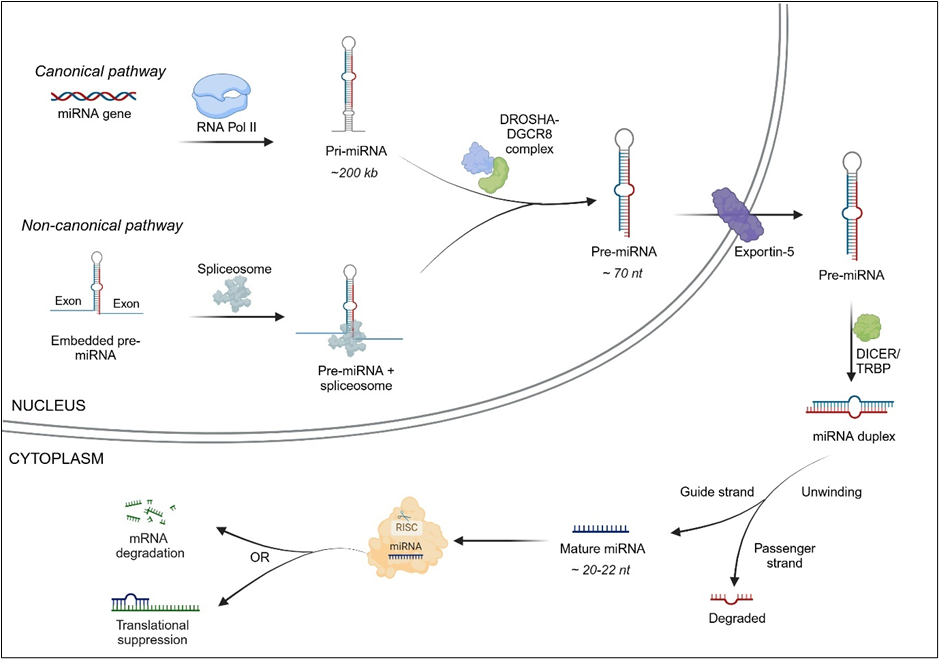
Na via canônica, os microRNAs são transcritos a partir dos genes de microRNA como longos transcritos primários de microRNA (pri-miRNAs) pela RNA polimerase II (ocasionalmente RNA polimerase III). Os pri-miRNAs podem ter vários quilobases de comprimento, com sequências flanqueadoras de 5' e 3', e podem conter as alças de haste de vários microRNAs maduros. Os pri-miRNAs são processados pela proteína nuclear DGCR8 (região crítica 8 da síndrome de DiGeorge) e pela enzima DROSHA em estruturas em forma de grampo chamadas transcritos de pré-miRNA.
Na via não canônica, os precursores de microRNA localizados dentro dos íntrons do mRNA são removidos por emenda, ignorando a etapa DGCR8/DROSHA. Os pré-miRNAs são então exportados para o citoplasma com a ajuda da exportina-5. Uma vez no citoplasma, a enzima RNase DICER atua no laço de grampo do pré-miRNA e o cliva para produzir um duplex maduro de microRNA. Uma das fitas do duplex de microRNA (a fita guia) associa-se à proteína Argonaut (AGO) no complexo de silenciamento induzido por RNA (RISC), enquanto a outra fita (fita passageira) é degradada. Normalmente, há uma preferência por qual fita é incorporada ao RISC com base em fatores como a estabilidade termodinâmica. Por fim, o mRNA alvo é degradado ou passa por supressão translacional.
Métodos de administração aprimorados aproximam descobertas importantes
Alcançar a administração eficaz de terapêuticas de microRNA para células-alvo é um desafio complexo devido à sua instabilidade e suscetibilidade à degradação. As metodologias atuais incluem sistemas virais (vírus adeno-associado, adenovírus e vetores lentivirais) e sistemas não virais (nanopartículas à base de lipídios, nanopartículas poliméricas, nanopartículas inorgânicas, vesículas extracelulares e peptídeos).
A administração de microRNA mediada por vírus provou ser eficaz, mas esse método também apresenta alta imunogenicidade. Vetores não virais, por outro lado, demonstram estabilidade relativa e baixa imunogenicidade. Como resultado, os pesquisadores estão explorando diversos tipos de nanoportadores não virais para administrar microRNA de maneira eficaz às células.
As nanopartículas à base de lipídios (LNPs) são os portadores mais comumente usados porque protegem o microRNA e têm boa biocompatibilidade. Os LNPs foram desenvolvidos recentemente a partir de lipídios catiônicos ionizáveis para uma administração mais eficiente do microRNA. Os LNPs também podem incluir "lipídios auxiliares", como colesterol ou dioleoilfosfatidiletanolamina (DOPE), para melhorar a estabilidade e reduzir a toxicidade. Foi demonstrado que a incorporação de polietilenoglicol (PEG) reduz a agregação de nanopartículas e aumenta o tempo de circulação.
Descobertas importantes também estão ocorrendo com portadores à base de polímeros, incluindo o poli(ácido lático-co-glicólico) (PLGA). Os pesquisadores desenvolveram uma estratégia de inibição do microRNA-210 com ácidos nucleicos de peptídeos γ antisense (γPNAs) que apresentam maior eficácia de ligação ao RNA e os encapsularam em nanopartículas de PLGA. O PLGA recebeu aprovação da FDA como veículo de administração e está em fase II de testes para terapias de RNA de interferência pequeno (siRNA).
Nanopartículas inorgânicas, como ouro e sílica, também mostram potencial como portadoras de microRNA, mas as preocupações contínuas com a toxicidade, particularmente com o ouro, podem limitar seu uso clínico.
Diferentes estratégias de uso de microRNAs como terapêutica
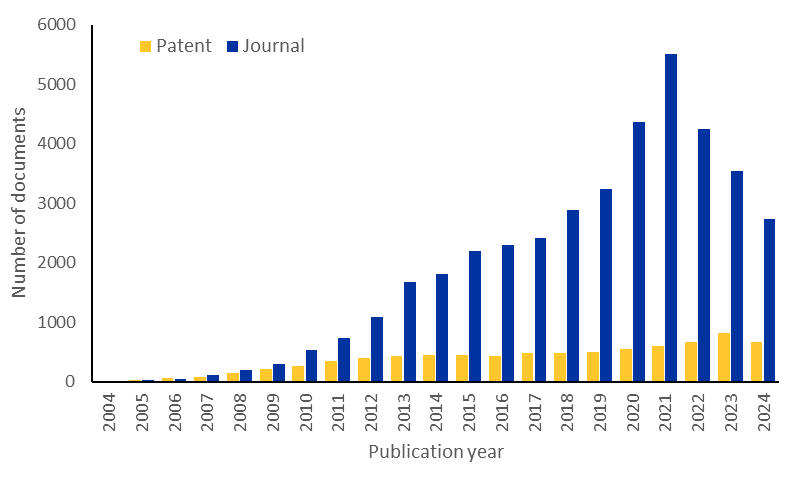
Examinamos o CAS Content CollectionTM, o maior repositório de informações científicas com curadoria humana, para entender melhor o cenário de pesquisa do microRNA. Houve um aumento notável nas publicações relacionadas ao microRNA nos últimos anos, embora as publicações em periódicos estejam diminuindo ligeiramente. No entanto, as publicações de patentes continuam a aumentar, sugerindo um interesse comercial sustentado nesta área (veja a Figura 2).
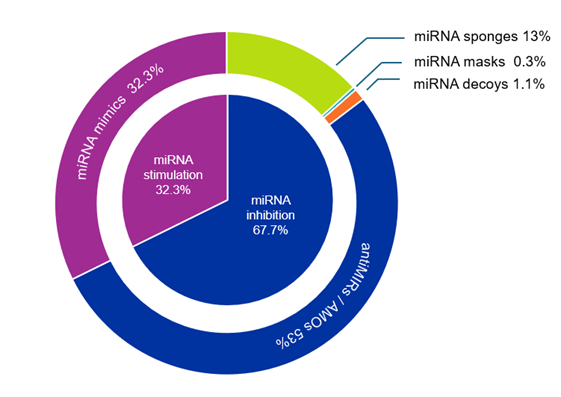
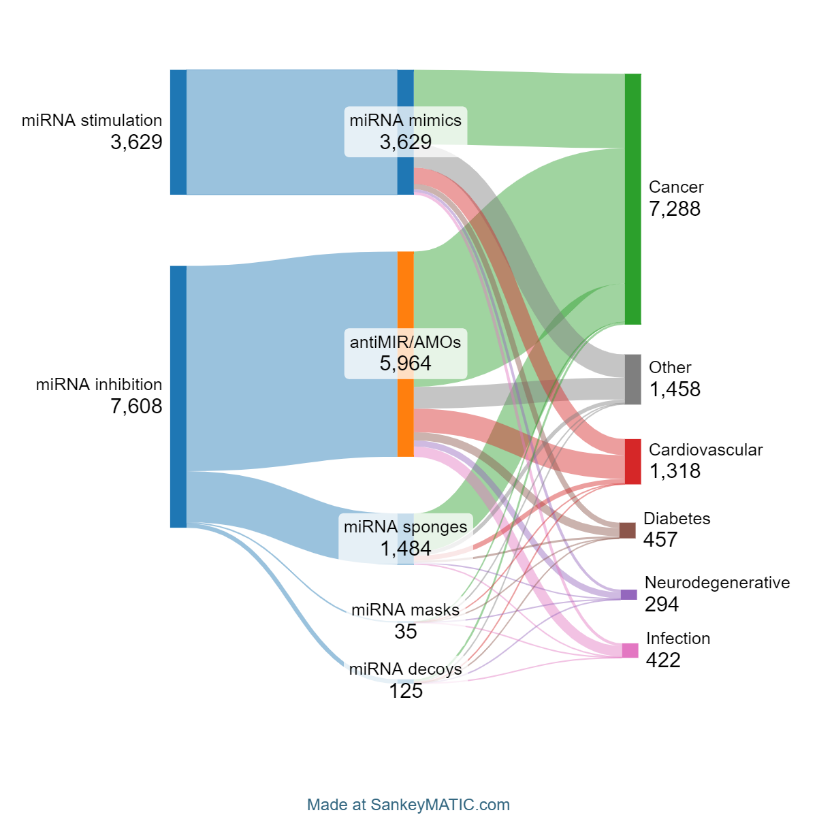
O objetivo das terapêuticas de microRNA é modificar e, idealmente, restaurar padrões de expressão de microRNA anormais ou patológicos. Atualmente, existem duas abordagens para alcançar isso: estimuladores ou intensificadores de microRNA e inibidores de microRNA. O primeiro grupo inclui principalmente imitadores de microRNA, enquanto o segundo grupo compreende oligonucleotídeos anti-MIR (AMOs), máscaras de microRNA, esponjas e chamarizes. Conforme visto na Figura 3, a maioria das publicações diz respeito a inibidores de microRNA (67,7%). Os AMOs são os mais comuns entre essas publicações.
Essas várias estratégias funcionam da seguinte forma:
- Imitação do microRNA: Moléculas sintéticas de RNA de fita dupla e pequeno porte que correspondem à sequência de microRNA correspondente, imitando a ação do microRNA sintetizado naturalmente. O objetivo é restaurar funcionalmente a expressão do microRNA perdida ou diminuída em condições patológicas.
- antiMIRs/AMOs/anatagomiRs: Moléculas sintéticas de RNA de fita simples e pequena, baseadas em oligonucleotídeos antissenso de primeira geração, que podem ter modificações químicas (por exemplo, antiMIRs com modificação 2-O-metoxietil também são chamados de antagomiRs). Eles se ligam funcionalmente aos microRNAs com sequências complementares e impedem sua interação com o mRNA-alvo, eventualmente aumentando sua expressão.
- Esponjas de microRNA: microRNA artificial contendo repetições em conjunto de sequências de oligonucleotídeos com locais de ligação de microRNA (MBSs) para um microRNA maduro de interesse. Eles sequestram os microRNAs endógenos-alvo, deixando os MBS nos mRNAs-alvo livres, o que leva à sua superexpressão. Os CircmiRs são esponjas circulares de microRNA com o mesmo mecanismo de ação, mas são mais estáveis.
- Chamarizes de microRNA: Uma variação de esponjas de microRNA caracterizadas por estruturas de haste e alça (a alça contém MBSs).
- Máscaras de microRNA: Oligonucleotídeos de fita simples com modificação 2ʹ-O-metoxietil (ou outra modificação química). São perfeitamente complementares aos MBSs na 3'UTR do mRNA-alvo, dificultando a interação entre o microRNA e o mRNA e aumentando os níveis de expressão do mRNA.
Explorando o potencial do microRNA como terapêutica
O microRNA poderia lidar com uma variedade de doenças devido à sua gama de funções na expressão gênica. De acordo com a nossa análise do CAS Content Collection, o câncer é a área terapêutica pesquisada com mais destaque (67,5%), seguido por distúrbios cardiovasculares (10,2%), infecções (4,5%), diabetes (4,4%) e distúrbios neurodegenerativos (4,3%) (veja a Figura 4).
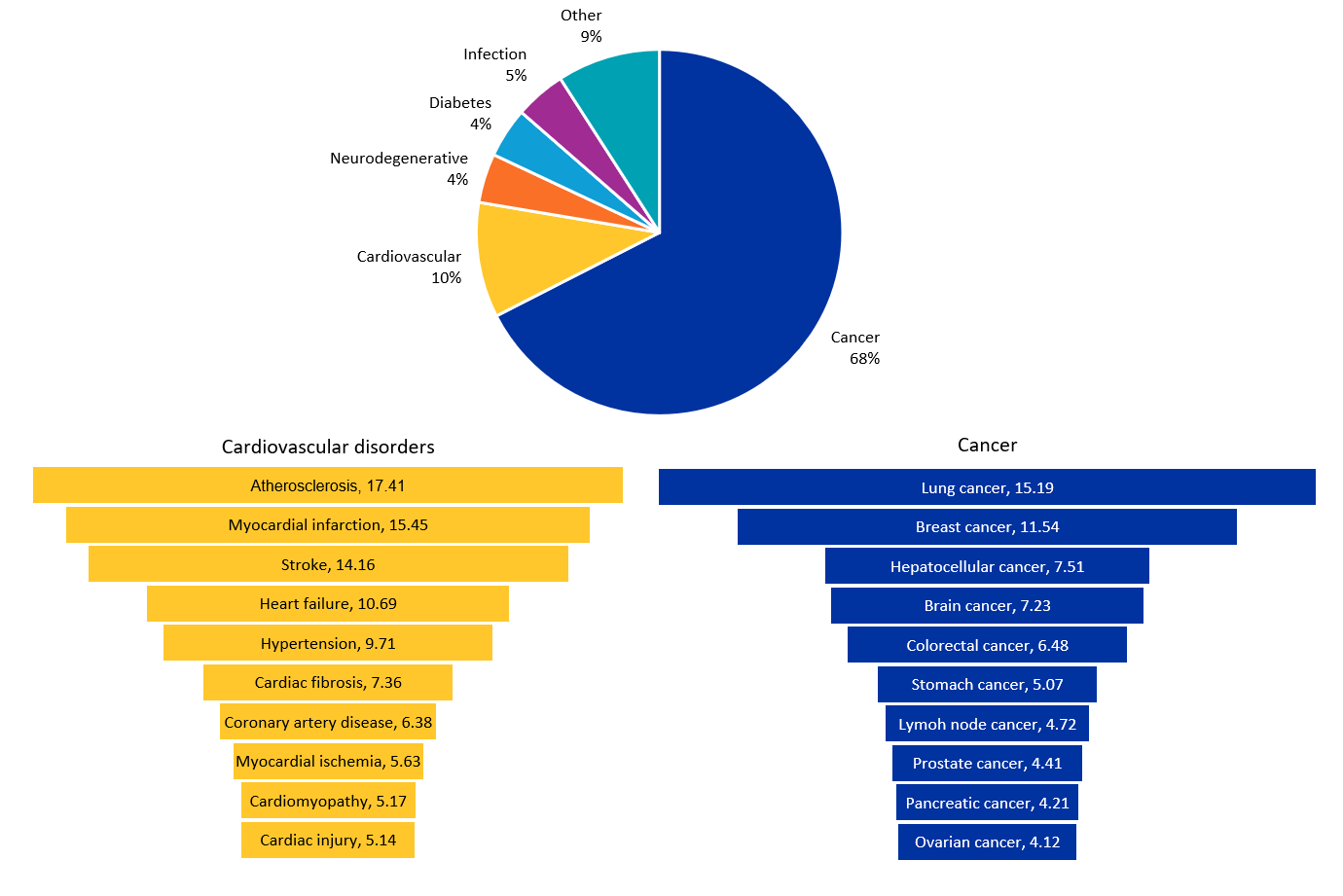
Câncer
Os miRNAs oncogênicos (oncomiRs) influenciam substancialmente o desenvolvimento do câncer ao participar de muitas vias de sinalização, incluindo a supressão de genes supressores de tumor e a ativação de oncogenes. A família miR-34 (miR-34a, miR-34b, miR-34c), que está sob o controle da regulação do gene supressor de tumor TP53, regula negativamente vários genes, como Cyclin D1, E2, CDK4, CDK6, BCl2 e Myc, levando à parada do ciclo celular e à apoptose e restringindo o crescimento do tumor. O cluster MiR-17-92, comumente referido como "oncomir-1", tem como alvo e inibe supressores tumorais como PTEN, p21 e E2F, levando ao aumento da proliferação celular, sobrevivência e angiogênese. O MiR-21 tem como principais alvos PTEN, PDCD4 e TIMP3 e ativa vias de suporte à sobrevivência como PI3K/Akt e MAPK, promovendo ainda mais o crescimento, invasão e metástase do tumor. Os microRNAs também desempenham um papel crítico na modulação da resistência a medicamentos das células cancerosas, além de regular os supressores tumorais e oncogenes.
Doenças cardiovasculares
Estudos de perfilamento recentes identificaram muitos microRNAs que são diferencialmente expressos em doenças cardiovasculares (DCV) de forma espaço-temporal, apontando para uma nova abordagem para regular condições como infarto do miocárdio, aterosclerose, insuficiência cardíaca, acidente vascular cerebral e hipertensão, entre outras. Os exemplos incluem miRNA-29 na fibrose cardíaca, miRNA-21 e miR-155 na cardiomiopatia e miRNA-34 no infarto do miocárdio. O miR-21 e o miR-29 também desempenham papéis cruciais na deposição da matriz extracelular durante a remodelação cardíaca patológica. A Dicer, uma enzima necessária para a maturação de todos os microRNAs, apresenta expressão aberrante durante a insuficiência cardíaca. Estudos funcionais demonstraram que o knock-out específico do coração da Dicer leva à cardiomiopatia progressiva, insuficiência cardíaca e morte em camundongos. Os dados disponíveis sugerem coletivamente que Dicer/microRNAs desempenham papéis cruciais nas funções cardíacas normais, assim como em condições patológicas, e estão sendo explorados como alvos terapêuticos na DCV.
Infecções
Os microRNAs estão sendo investigados nas interações hospedeiro-patógeno de mais de 50 infecções (bacterianas, virais, fúngicas e parasitárias). Há várias maneiras pelas quais os microRNAs podem ajuda a combater doenças infecciosas. Eles regulam proteínas específicas envolvidas nas vias imunes inatas e adaptativas, ajudando a ajustar a resposta imunológica às infecções. Eles podem ser usados para direcionar genes de patógenos e inibir a sua replicação. Por exemplo, tratamentos como RG-101 e miravirsen (inibidores do miR-122) têm como alvo os microRNAs do hospedeiro para combater a infecção por hepatite C. MicroRNAs também estão sendo investigados para criar vacinas atenuadas ao incorporar elementos de resposta de microRNA nos genomas de vacinas virais. Alguns patógenos, como o Ebola, produzem seus próprios microRNAs, que podem ser alvos para reduzir sua patogenicidade e melhorar os resultados do tratamento.
Diabetes
Evidências emergentes sugerem que os microRNAs desempenham um papel crucial nas funções das células beta (sobrevivência, proliferação, diferenciação e secreção de insulina) e na modulação da resistência ou sensibilidade à insulina. Eles podem influenciar as respostas inflamatórias, que geralmente são exacerbadas em pacientes diabéticos. Ao reduzir a inflamação, os microRNAs podem auxiliar no gerenciamento das complicações associadas ao diabetes. Vários ensaios pré-clínicos e estudos in vitro visando encontrar terapêuticas baseadas em microRNA para diabetes mostraram resultados promissores.
Doenças neurodegenerativas
Os microRNAs podem regular a expressão de genes envolvidos em doenças neurodegenerativas, reduzir a neuroinflamação e proteger os neurônios da apoptose. Os exemplos incluem miR-124 e miR-132, que dão apoio à saúde e à função neuronal, e as famílias miR-29 e miR-34, que têm como alvo genes associados à produção de beta-amiloide na doença de Alzheimer. Os microRNAs também podem promover a neurogênese, que é crucial para o reparo do cérebro, com miR-9 e miR-124, conhecidos por desempenhar papéis importantes na neurogênese. MicroRNAs desregulados podem causar deterioração neurológica e o desenvolvimento de doenças neurodegenerativas. Portanto, a modulação desses microRNAs oferece uma nova abordagem para o tratamento dessas condições.
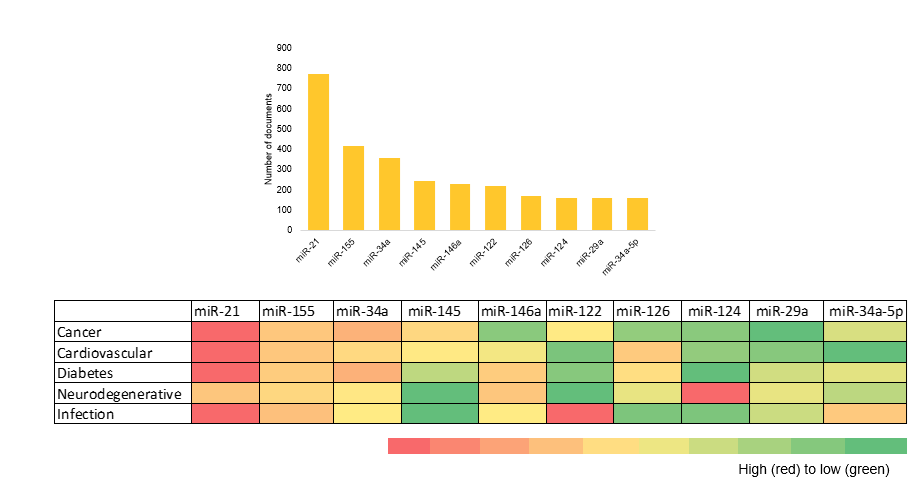
Traçamos os microRNAs de ocorrência mais comum no conjunto de dados da literatura e visualizamos sua distribuição nas cinco principais áreas terapêuticas como parte de nossa análise (veja a Figura 5).
Também realizamos uma análise de coocorrência para determinar quais tipos de terapias de microRNA estão mais intimamente associados às cinco principais condições na literatura (veja a Figura 6).
Perspectivas para terapêuticas de microRNA
Vemos novos avanços promissores em terapias de microRNA. No entanto, desafios persistentes ainda precisam ser superados antes que esses tratamentos possam ser utilizados na prática clínica. Ensaios clínicos devem ser realizados para confirmar a segurança e eficácia de diferentes estratégias e métodos de administração de microRNA. A resposta imune indesejada, o acúmulo não específico de tecido e a degradação endossômica são outros desafios significativos no desenvolvimento de terapêuticas baseadas em microRNA.
Pesquisas recentes demonstram que estão ocorrendo descobertas importantes, e o futuro é brilhante para essas terapias. Tecnologias avançadas como CRISPR/CAS para direcionar genes de microRNA e modelos baseados em inteligência artificial para prever alvos de microRNA demonstram oportunidades empolgantes para o desenvolvimento de terapêuticas de microRNA.
As terapias de microRNA poderão em breve transformar o cuidado de pacientes para inúmeras doenças por meio da inovação contínua.